TERMODINAMICA
¿Qué es la termodinámica?
Se llama termodinámica (del griego thermós, “calor” y dynamos, “poder, fuerza”) a la rama de la física que estudia las acciones mecánicas del calor y de otras formas semejantes de energía. Su estudio aborda los objetos como sistemas macroscópicos reales, mediante el método científico y razonamientos deductivos, prestando atención a variables extensivas como la entropía, la energía interna o el volumen; así como a variables no-extensivas como la temperatura, la presión o el potencial químico, entre otros tipos de magnitudes.
Sin embargo, la termodinámica no ofrece una interpretación de las magnitudes que estudia, y sus objetos de estudio son siempre sistemas en estado de equilibrio, es decir, aquellos cuyas características son determinables por elementos internos y no tanto por fuerzas externas que actúan sobre ellos. Por esa razón, considera que la energía sólo puede intercambiarse de un sistema a otro a manera de calor o de trabajo.
El estudio formal de la termodinámica inició gracias a Otto von Guericke en 1650, un físico y jurista alemán que diseñó y construyó la primera bomba de vacío, refutando con sus aplicaciones a Aristóteles y su máxima de que “la naturaleza aborrece el vacío”. Luego de esta invención, los científicos Robert Boyle y Robert Hooke perfeccionaron sus sistemas y observaron la correlación entre presión, temperatura y volumen. Así nacieron los principios de la termodinámica.
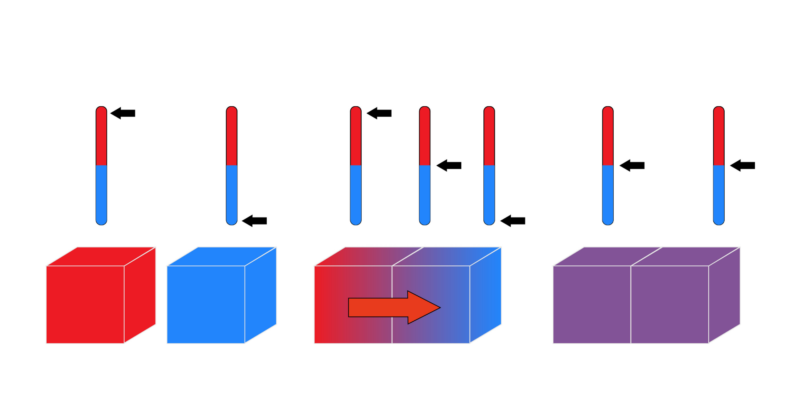
Sistema termodinámico

Se entiende sistema termodinámico a una parte del universo que, con fines de estudio, se aísla conceptualmente del resto y se intenta comprender de manera autónoma, tomando nota de los modos en que la energía cambia o se preserva, y al mismo tiempo, de haberlos, sus intercambios de materia y/o energía con el entorno o con otros sistemas semejantes. Se trata, pues, de un método de estudio de la termodinámica.
El criterio principal de clasificación de estos sistemas se basa en su grado de aislamiento del entorno, distinguiendo así entre:
- Sistemas abiertos. Aquellos que intercambian libremente energía y materia con su entorno, como hacen la mayoría de los sistemas conocidos en la cotidianidad: un vaso con agua fría lentamente se irá calentando debido a la acción del calor del aire alrededor.
- Sistemas cerrados. Aquellos que intercambian energía con su entorno, pero no materia. Es lo que ocurre con un envase cerrado, como una lata, cuyo contenido es invariable, pero pierde calor con el tiempo, disipándolo en el aire alrededor.
- Sistemas aislados. Aquellos que, hasta cierto punto, no intercambian energía ni materia con el entorno. No existen los sistemas perfectamente aislados, claro está, pero sí hasta cierto grado: un termo que contiene agua caliente preservará su temperatura durante un rato, lo suficiente como para conservarse aislado durante un rato.
Leyes de la termodinámica

La termodinámica se rige por lo establecido en sus cuatro principios o leyes fundamentales, formuladas por diversos científicos a lo largo de la historia de esta disciplina. Dichos principios o leyes son:
- Primer principio, o Ley de la Conservación de la energía. Establece que la cantidad total de energía en cualquier sistema físico aislado de su entorno, será siempre la misma aunque pueda transformarse de una forma de energía a muchas otras diferentes. En menos palabras: “La energía no puede crearse ni destruirse, sólo transformarse”.
- Segundo principio, o Ley de la Entropía. Esta ley dicta que “la cantidad de entropía en el universo tiende a incrementarse en el tiempo”, lo cual significa que el grado de desorden de los sistemas (la entropía) aumenta una vez que alcancen un punto de equilibrio. Así, dado el tiempo suficiente, todos los sistemas tenderán al desequilibrio. Con esta ley se explica la irreversibilidad de los fenómenos físicos: una vez quemado un papel, no puede hacer que regrese a su forma inicial.
- Tercer principio, o Ley del cero absoluto. Dicta que la entropía de un sistema que sea llevado al cero absoluto será siempre una constante definida, lo cual dicho en otras palabras significa que al llegar al cero absoluto (-273,15 °C o 0 K), los procesos de los sistemas físicos se detienen, y la entropía poseerá un valor mínimo constante.
- Principio cero o Ley del equilibrio térmico. Se llama “ley cero” porque, si bien fue la última en postularse, los preceptos básicos y fundamentales que establece tienen prioridad sobre las otras tres leyes. Dicta que “Si dos sistemas están en equilibrio térmico de forma independiente con un tercer sistema, deben estar también en equilibrio térmico entre sí”.
Termodinámica química
La termodinámica química es un campo de estudio aparte, centrado en la correlación entre el calor y el trabajo, y las reacciones químicas, todo enmarcado en lo establecido por los principios de la termodinámica. Es decir, se trata de la aplicación de las leyes de la termodinámica, especialmente de las dos primeras, al mundo de las reacciones entre sustancias y compuestos, para obtener así las llamadas “ecuaciones fundamentales de Gibbs”, las cuales rigen el modo en que la energía química contenida en los distintos compuestos cambia y se transmite, o cómo aumenta el grado de entropía del universo cada vez que una reacción espontánea ocurre.

Comentarios
Publicar un comentario